IMPLANTATIONSKAMMER
Aufgabenstellung
Ziel des Projekts war die Entwicklung einer therapeutisch einsetzbaren Implantationskammer für Insulin produzierende nicht-beta-Zellen. Im Gegensatz zu konventionellen Therapieverfahren von Diabetes mellitus sollte hier eine Implantationskammer für lebende Zellen entwickelt werden, die zur Freisetzung von Insulin unter externer physikalischer Stimulation fähig sind. Die Zellen sollten vor ihrer Nutzung in vitro so gentransfiziert werden, dass das humane Insulingen in das eigene Genom eingebaut wird und sie in der Lage sind, Insulin zu sezernieren.
Ergebnisse
Der Grundkörper der entwickelten Prototypenkammern besteht aus einem Chirulen-Ring, in den zwei Edelstahlröhrchen zum Einfüllen der Zellsuspension und gleichzeitigen Entlüftung eingebracht wurden. Die Befüllung erfolgt mit Hilfe einer Spritze. Zwei verschiedene Polyethersulfon-Membrantypen wurden als äußere, den Kulturraum begrenzende Membranen getestet: Omega mit einem MWCO von 100 kD und Nadir mit einem MWCO von 50 kD. In den Innenraum wurden vier verschiedene Gewebetypen eingelegt, auf und in denen die Zellen wachsen konnten: Porex hydrophob, Porex PE, Porex T3 und 6-Eck-Gewebe.
Die Implantationskammern wurden mit 20.000 Zellen pro Kammer inokuliert und für acht Wochen inkubiert. Da die Kammern nicht transparent sind und ein geschlossenes System bilden, können hier weder das Zellwachstum noch die Vitalität beobachtet werden.
Als Vergleich wurden 24well-Platten ebenfalls mit 20.000 Zellen pro Well inokuliert und ihr Wachstum und ihre Vitalität beobachtet.
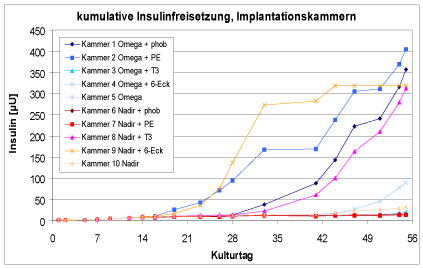
Die Implantationskammern zeigen eine sehr unterschiedliche Insulinfreisetzung, die an unterschiedlichen Kulturtagen stärker einsetzt. Der Erhalt der Insulinfreisetzung zeigt, dass in den Kammern vitale Zellen kultiviert werden.
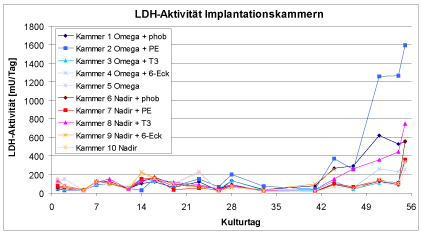
Die Implantationskammern zeigen während der ersten sechs Wochen eine geringe LDH-Aktivität, die während der letzten beiden Kulturwochen bei allen Kammern ansteigt. Dabei zeigen die „aktivsten“ Kammern auch die höchste LDH-Aktivität. Dies ist eine weitere Bestätigung der Annahme, dass hier auch die höchsten Zellzahlen vorliegen. Die LDH-Aktivitäten lassen darauf schließen, dass die Zellen in den Implantationskammern über sechs Wochen eine hohe Membranintegrität und Vitalität aufweisen, die während der siebten Woche langsamer und während der achten Woche stark abnehmen. Damit bleibt die Leistungsfähigkeit der Zellkultur dreimal solange erhalten wie in der 24well-Platte.
Derzeitiger Stand
Wie die Ergebnisse zeigen, sind die Prototypen des entwickelten Kammersystems grundsätzlich für den Einsatz zur Insulinproduktion geeignet. Die gewählten Membranen sind für Nährstoffe und Insulin durchlässig und setzen sich während des achtwöchigen Kulturzeitraums nicht zu. Die Insulinfreisetzung liegt etwa im gleichen Bereich wie die der Vergleichszellen in einer Standardkultur. Der Grundmetabolismus und die Membranintegrität der Zellen sind im Vergleich zu den Kontrollzellen in den Implantationskammern sogar besser, der Kultivierungszeitraum verdreifacht sich.
Derzeit ist die Menge des freigesetzten Insulins für einen therapeutischen Ansatz noch zu niedrig . Eine erfolgreiche Dosierung mit Hilfe eines Glukosesensors ist hier nicht möglich, da die Glukose im Nährmedium im Überschuss zur Verfügung steht und freigesetztes Insulin somit sofort aktiv wird. Für eine höhere Insulinfreisetzung ist somit eine höhere Zellzahl und damit ein größeres Kammervolumen nötig.
Für eine Weiterentwicklung liegen bereits Ideen und Konzepte vor. Es müssen aber neue Partner für die Entwicklung und Finanzierung gefunden werden.